2. 材料和方法
2.1. 材料
2.1.1. 培养基、溶液和实验室材料的制备
所有用于微生物程序的培养基和溶液,以及微管、试管、Falcon 管、镊子、微量移液器吸头等材料,均在 Prismatec ® CS-A 系列立式高压 灭菌器(Prismatec Indústria e Comércio,Itu)中进行灭菌。 ,SP,巴西)在 121 °C 下持续 30 分钟。自来水在 Master System All(型号 MS2000,Gehaka,圣保罗,SP,巴西)中纯化至最终电阻率约 100%。18.18 MΩ·cm,电导率为0.05 µS·cm -1,用于所有介质和溶液的制备。培养基和试剂在 Marte Científica ®的分析天平(型号 OHAUS AS200S,Santa Rita do Sapucai,MG,巴西)上称重 。生物安全柜(型号 Filterflux ® Class II B2,SPLab,Piracicaba,SP,巴西)用于细菌、噬菌体、培养基的操作和微生物活性测量。
2.1.2. 生物材料
Cefar Diagnóstica(圣保罗,SP,巴西)提供了 用作细菌宿主的肠沙门氏菌CCCD-S004 菌株收集细菌。
噬菌体 SentS01L 是从湖水中分离出来的,而噬菌体 SentS01T 是从土壤样品中分离出来的,两者均采集于巴西索罗卡巴市 UNIS 兽医医院周围(地理坐标:23°29′58.7″ S;131 47°) 23′45.2″ 西)。
2.1.3. 化学品
试剂购自 (i) Dinâmica Química Contemporânea Ltd. (Diadema, SP, Brazil)(无水磷酸氢二钠、磷酸二氢钠、氯化钙和氯化钠);(ii) Sigma-Aldrich(美国密苏里州圣路易斯)(培养基胰蛋白酶大豆琼脂 (TSA) 和胰蛋白酶大豆肉汤 (TSB)、聚乙二醇 (PEG) 8000、d-葡萄糖酸内酯 (GDL)、硫酸镁、Trizma盐酸盐(Tris-HCl)、海藻酸钠和乙酸双氧铀);(iii) Gibco Diagnostics(美国威斯康星州麦迪逊)(微生物固体琼脂);(iv) Merck-Millipore(德国达姆施塔特)(灭菌过滤系统/Stericup™-GP);(v) Labsynth(Diadema,SP,巴西)(硫酸镁);(vi) Anidrol(Diadema,SP,巴西)(碳酸钙(CaCO 3));(vii) BioRad(Santo Amaro,SP,巴西)(裂解缓冲液、分子量标记和考马斯亮蓝 G-250)。
2.2. 实验步骤
2.2.1. 合适的肠沙门氏菌菌悬液的制备 CCCD-S004
宿主细菌在固体 TSA 中于 37°C 孵育 12 小时,然后在 TSB 液体培养基中水合。
2.2.2. 使用倾注板技术检测细菌草坪(肠沙门氏菌CCCD-S004)
为了制备宿主菌苔,将 100 µL 细菌悬浮液添加到装有 5 mL 熔融顶部琼脂-TSB (MTA-TSB) 的管中。均质化后,将这些样品倒入含有固体 TSA 的板中,使其干燥,然后在 37°C 下孵育 12 小时。
2.2.3. 两种噬菌体悬浮液中裂解活性的现场测试验证
为了验证分离噬菌体的裂解活性,将 10 µL 每种噬菌体悬浮液倒入宿主细菌菌苔上,并在 37 °C 下孵育过夜。此后,可以看到清晰的裂解区,这是裂解噬菌体存在的标志。
2.2.4. 噬菌体病毒粒子 PEG-沉淀
在聚乙二醇 (PEG) 8000 (10%, w / w ) 和 NaCl (1 mol/L) (2:1) 的无菌混合物中添加噬菌体悬浮液样品。这些悬浮液在 4°C 下孵育 12 小时,之后将样品离心(11,000 rpm,4°C,45 分钟)。将沉淀重悬于5mM MgSO 4中,并弃去上清液。
2.2.5。噬菌体计数
根据Adams [ 18 ],测定噬菌体滴度。使用库存噬菌体悬浮液 (50 µL) 和 SM 噬菌体缓冲液 (450 µL)(200 mM NaCl;10 mM MgSO 4;和 50 mM Tris-HCl,pH 7.5)制备系列稀释液。按顺序,将 50 µL 每种稀释液添加到 100 µL 生长的细菌培养物和 4 mL MTA-TSB 中。将悬浮液添加到 TSA Petri 板中并在 37°C 下孵育 12 小时。在此时间范围之后,在每个稀释度中都观察到裂解斑,并考虑到含有 20-200 个噬菌体斑的稀释度进行计数。接下来,噬菌体效价(PFU/mL)计算为形成的噬菌斑数量×1稀释度×1V噬菌体接种量(mL)
。所得噬菌体滴度为1.40 × 10 12 PFU/mL(噬菌体SentS01L)和1.72 × 10 12 PFU/mL(噬菌体SentS01T)。
2.2.6。透射电子显微镜 (TEM) 分析
将噬菌体颗粒在 Beckman-Coulter 的微量超速离心机(型号 Optima TLX,印第安纳波利斯,印第安纳州,美国)中以 45,000 rpm、4 °C 离心 150 分钟。使用 2% ( w / v ) 和 pH 7.0 的醋酸双氧铀对样品进行负染色,[ 21 , 22 ],并使用高分辨率 CCD 相机在 JEOL 透射电子显微镜(型号 JEM 2100,日本东京)中进行显微照相来自 GATAN Inc.(型号 ORIUS™ 832.J4850 SC1000B,美国加利福尼亚州普莱森顿)。使用软件Gatan Microscopy Suite(来自GATAN Inc.的DigitalMicrograph,版本2.11.1404.0)来获取噬菌体病毒颗粒的数码照片。
2.2.7. 十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE) 分析噬菌体病毒粒子结构蛋白
SDS-PAGE 用于测定噬菌体 SentS01L 和 SentS01T 结构蛋白的分子量,采用 Bio-RAD(Hercules,CA,USA)的 Mini-PROTEAN ® Tetra Cell。在 Eppendorf 中,向每个噬菌体悬浮液样品中添加 500 µL 破坏缓冲液,并将混合物煮沸 10 分钟。然后,将 20 µL 样品上清液和 5 µL 分子量标记物加入到 5% 丙烯酰胺-双丙烯酰胺浓缩胶/12% 丙烯酰胺-双丙烯酰胺分离胶中,电泳 60 分钟。使用考马斯亮蓝 G-250 对凝胶进行染色,然后以高分辨率拍照以供进一步分析。
2.2.8. 结合裂解噬菌体混合物的可食用抗菌涂层(Ediphage)的配制和表征
EBP 薄膜的配制。EdiPhage 制剂(表 1)是通过内部凝胶化制备的,如 Balcão 等人所述。[ 23 , 24 ] 和Łętocha 等人。[ 25 ]。采用内部凝胶化法使海藻酸盐在室温下聚合72 h。为了引发藻酸盐聚合,使用新鲜的 δ-葡萄糖酸内酯 (GDL) 水溶液来释放分散在配方中的钙离子。使用碳酸钙(CaCO 3 )作为钙离子源。将先前制备的聚合物分散体与该水解溶液均化,并将奶酪样品浸入其中。此后,将奶酪基质保存在 4°C 下,直至进行进一步分析。
表 1. 含有(或不含)噬菌体颗粒的可食用抗菌涂层 (EdiPhage) 的配方。
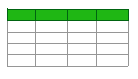
基于 Pereira 等人之前的工作,使用了适当的噬菌体病毒粒子/细菌细胞比率(即感染复数 MOI),旨在灭活宿主细菌(即 MOI 100 和 MOI 1000)。[ 21 ]。
埃迪噬菌体厚度。使用分辨率为 0.001 mm 的卡尺,通过对每个 EdiPhage 面积进行五次随机测量来确定聚合涂层的平均厚度。
集成在食用抗菌涂层中的噬菌体颗粒的裂解活力的维持评估。从奶酪基质样品中取出 EdiPhage 样品,并将其置于 肠沙门氏菌 CCCD-S004 菌苔的中心。37°C 孵育 24 小时后,进行宏观分析,观察 EdiPhage 样品周围菌苔中是否存在清晰的裂解区域。
通过 圆盘扩散测定评估食管噬菌体的细胞毒性潜力。采用永生化人角质形成细胞 (HaCaT) 和小鼠成纤维细胞 (3T3) 细胞系的纸片扩散测定 [ 26,27,28 ]用于评估 EdiPhage 整合裂解噬菌体混合物的细胞毒性潜力。将含有细胞的培养皿充满一小片样品(EdiPhage),并在37°C、5% CO 2 气氛中孵育24小时。相同的方案用于阴性对照(无毒纸盘)和阳性对照(乳胶)。由于测试样品周围的细胞裂解而形成透明光环,从而检测到细胞毒性的存在[ 29 ]。
通过 能量色散 X 射线荧光 (EDXRF) 分析测定食管元素组成。使用来自 Amptek(美国马萨诸塞州贝德福德)的能量色散 X 射线荧光光谱仪 (EDXRF) 来测定 EdiPhage 制剂的元素组成。每次测量均在环境空气中进行,每个样品的测量时间固定为 300 秒(实时时间)。
傅里叶变换红外分光光度法 (FTIR) 分析。使用 Agilent 的傅立叶变换红外分光光度计(型号 Cary 630,美国加利福尼亚州圣克拉拉)测量 EdiPhage 样品的 FTIR 光谱。测量在4000cm -1 至400cm -1 的范围内 以及2cm -1的分辨率下获得。
通过差示扫描量热法 (DSC) 进行热分析。Shimadzu 的 DSC-60 微量热计(型号 DSC-60,日本京都)与热分析仪 TA 60W(Shimadzu,京都,日本)结合使用进行 DSC 分析。使用的参数是温度从大约增加到。25 °C 至 300 °C,加热速率为 10 °C min -1,在惰性气氛下(50 mL min -1的氩气 [ 26 ])。样品重 1.080 mg(普通 EdiPhage)和 1.820 mg(生物活性 EdiPhage)。
通过 X 射线透射 (XRT) 进行断层扫描分析。采用 Bruker microCT(型号 SkyScan 1174,Kontich,比利时)的 X 射线透射断层扫描仪拍摄断层图像。Bruker 的软件 NRecon™(版本 1.6.9.4,Kontich,比利时)使用 Feldkamp 等人的算法。[ 30 ]在重建断层图像的过程中。软件 CTVox™(版本 2.6.0 r908-64 位,来自 Bruker microCT)、CTan™(版本 1.13.5.1-64 位,来自 Bruker microCT)和 CTvol(版本 2.2.3.0-64 位,来自 Bruker microCT)用于处理断层扫描图像。
扫描电子显微镜分析 (SEM)。EdiPhage 样品的图像是使用扫描电子显微镜(JEOL,型号 JSM-IT200,东京,日本)和能量色散 X 射线光谱仪 (EDS) 检测器(JEOL,型号 DRY SD™25 检测器单元,东京)获得的, 日本)。样品涂层是通过金属化装置中的金(92 埃厚)阴极粉碎制备的。
机械阻力特性。使用 Stabile Micro Systems 的质构仪(型号 TA-TX Plus,Godalming,UK)评估 EdiPhage 的机械质量,最大力为 5 kg,距离为 5 mm。所有实验均一式三份进行,样品尺寸为 3 cm × 2 cm。
2.2.9. 统计分析
使用GraphPad Prism 7.04软件(GraphPad Software,圣地亚哥,加利福尼亚州,美国)对数据进行统计分析。使用 Kolmogorov-Smirnov 检验检查数据的正态分布。使用 Levene 检验评估方差齐性。使用双向方差分析和 Bonferroni 事后检验测试细菌浓度的显着性。p < 0.05的值 被认为具有统计显着性。
